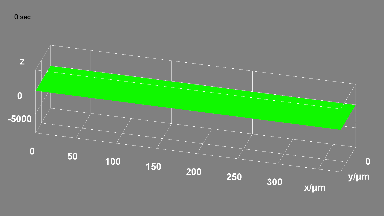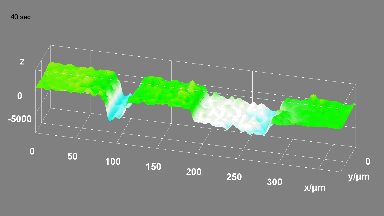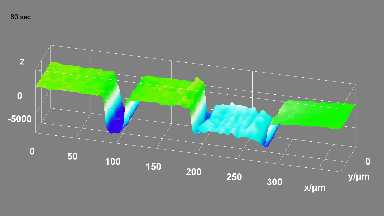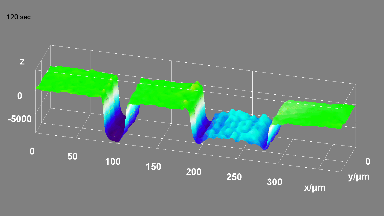
Ionenkanäle
Beschreibung
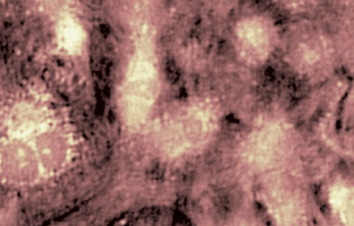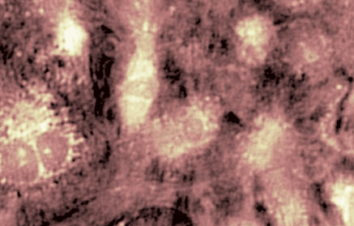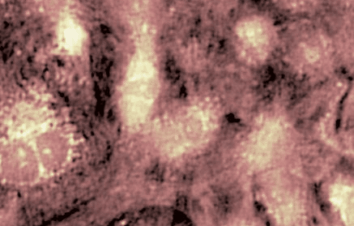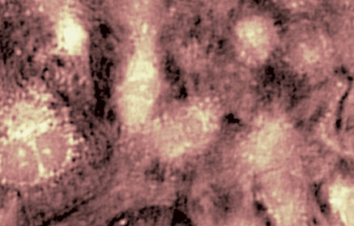
GABAA-Rezeptor (Ligand-gated Chloride Channel). Chloridkanäle haben eine Aussagekraft über eine ganze Reihe klinischer Indikationen. Aber das molekulare Screening von Chloridkanal-Modulatoren mit Hilfe von fluoreszierenden Farben oder invasiven Patch-Clamp-Techniken erwies sich als schwierig und zeitaufwändig. In dieser Anwendung wurden GABAA gesteuerte Chlorid-Ströme mit dem DHM® aufgezeichnet und mit elektrophysiologisch aufgenommenen Daten verglichen.
Material und Methoden
- Biologisches Modell: HEK Zellen mit α1, β2 und γ2s Untereinheiten von GABAA-Rezeptoren (HEKGABA)
- DHM® Lösung: nicht-invasive optische Patch-Clamp Methode von GABAA-Rezeptoren
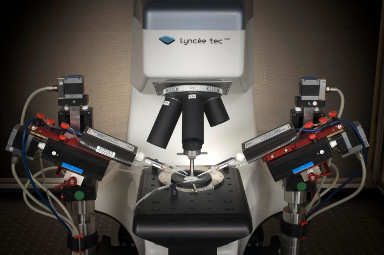
- Elektrophysiologisches Recording: ganzes Zell-Patch-Clamp-System rund ums DHM® (Illustration 1).
- Daten Analyse: Betrachten der optischen Patch-Clamp Messung mit dem DHM® mit aufgenommenem elektrophysiologischem Strom.
Resultate
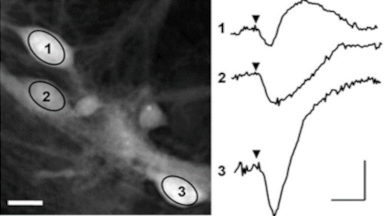
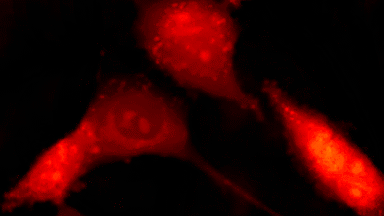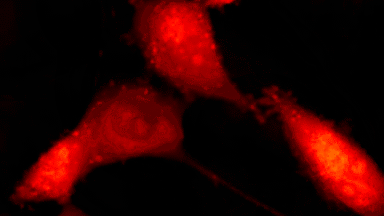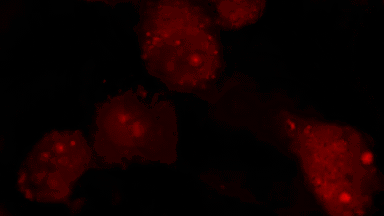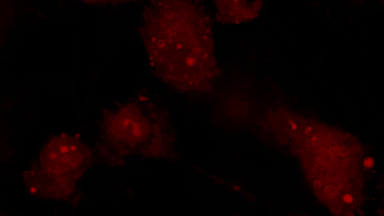
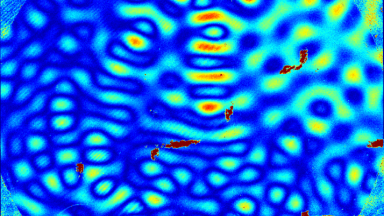
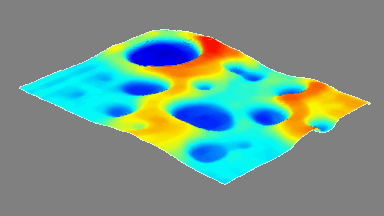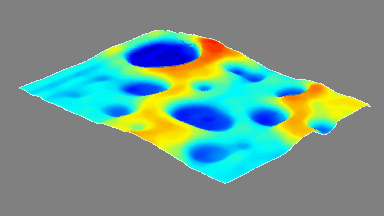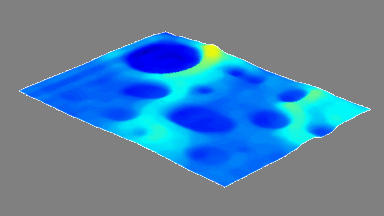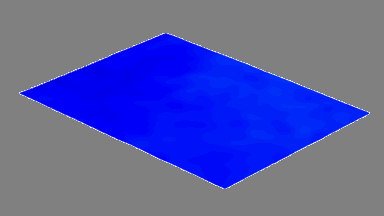
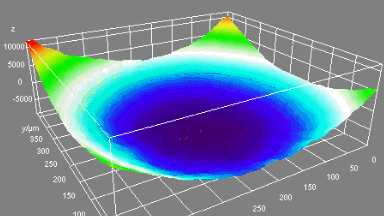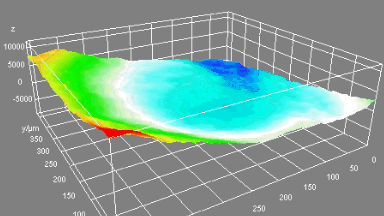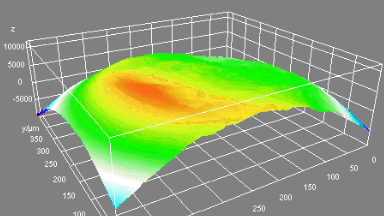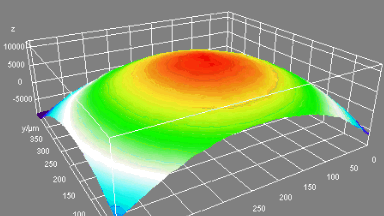
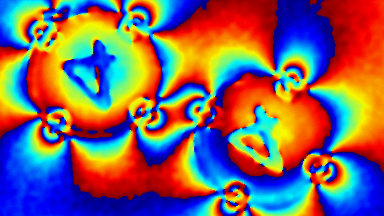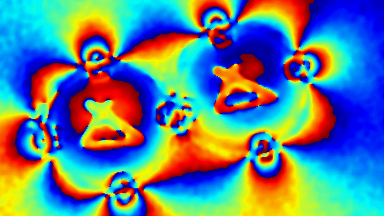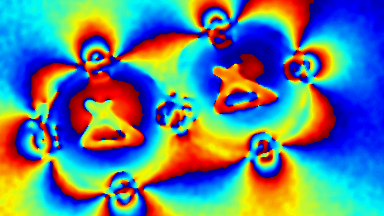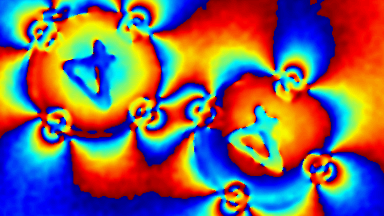
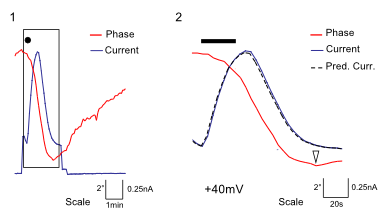
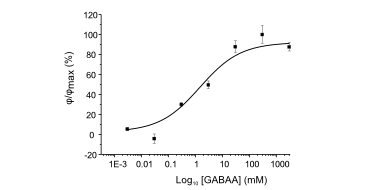
Das DHM® kann nicht-invasiv und quantitativ den transmembranen Chloridaustausch messen, initiiert durch die Aktivierung der Membranleitfähigkeit mit GABAA-Rezeptoren. In der Tat kann der Chloridfluss, gesteuert mit der Zugabe von Agonisten des GABAA-Rezeptors, über das mit dem DHM® erhaltenen quantitativen Phasensignal mit einem patentierten Algorithmus abgeleitet werden. Im Weiteren eignet sich das DHM® zur Bestimmung pharmakologischer Charakteristiken von GABAA-Rezeptoren über das Sampling einer grossen Anzahl Zellen – nicht-invasiv, simultan, schnell.
Figures 1 & 2 (von Jourdain et al., PLoS One, 2012)
Publikationen
„I am proud to be one of the first owners of a DHM®.
The innovative data we generate with our microscope trigger major contributions to Optical electrophysiology.“
Dr Pascal Jourdain
Center for Psychiatric Neuroscience, CHUV university hospital, Cery,
Switzerland

Beschreibung
Die ionotropischen Glutamat Rezeptoren (NMDA und nicht-NMDA) sind an einer ganzen Anzahl physiologischer Prozesse (neuronale Entwicklung, Gedächtnis, etc.) wie auch an pathologischen Prozessen (Schlaganfall, Durchblutungsstörung, Neurodegeneration, etc.) beteiligt. Der ionotropische Glutamat-Rezeptor ist ein attraktives therapeutisches Ziel in der neurologischen Pathologie.
Material und Methoden
- Biologisches Modell: Primäre Kulturen von kortikalen Neuronen entnommen von E17 OF1 Maus Embryos beiden Geschlechts
- DHM® Lösung: nicht-invasives optisches Messen von NMDA und nicht-NMDA Rezeptoren
- Elektrophysiologisches Messen: ganzes Zell-Patch-Clamp-System integriert ins DHM® (Illustration 1)
- Kalzium Imaging: Kalzium System integriert ins DHM® (Illustration 2)
Resulte
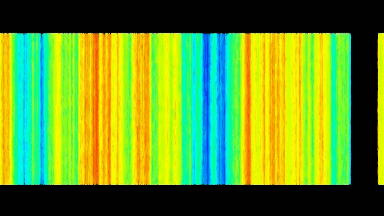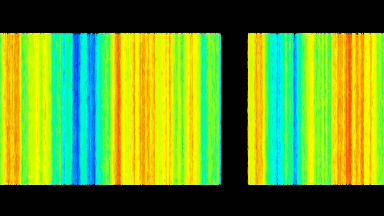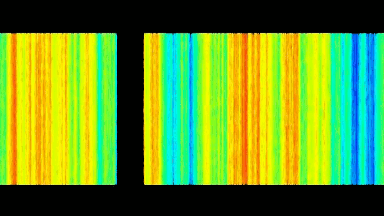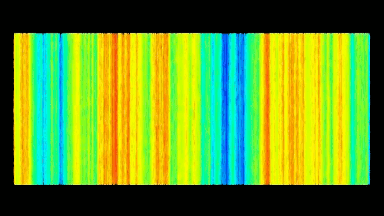
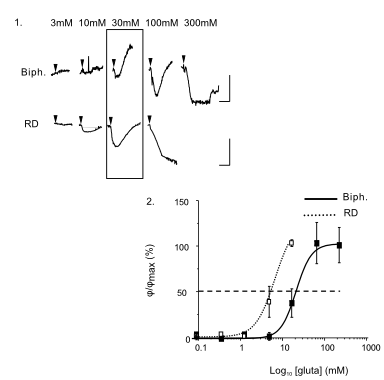
Das DHM® detektiert in einer dynamischen und nicht-invasiven Art die Aktivität von NMDA und nicht-NMDA Rezeptoren und liefert damit eine genaue Indikation des physio-pathologischen Status von Neuronen. Gleichzeitig können deren pharmakologische Parameter sehr präzise bestimmt werden für jeden Typ des ionotropischen Glutamat-Rezeptors.
Figur 3 (von Jourdain et al., J. Neurosc., 2011)
Publikationen
Pavillon et al., JBO, 2010; Jourdain et al., J. Neurosc., 2011; Pavillon et al., PLoS One, 2012

Beschreibung
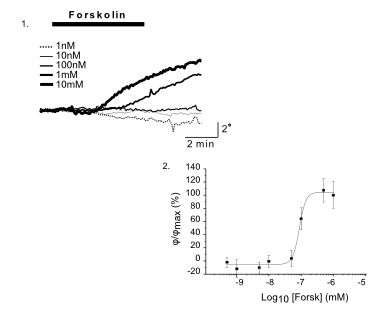
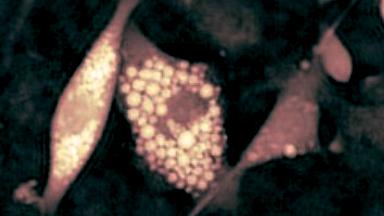
CFTR Protein (cAMP-aktivierter Chloridkanal). Der CFTR (Cystic Fibrosis Transmembrane Conductance Regulator) Protein ist ein Apex Membranprotein mit der Funktion eines Chloridkanal-Reglers für den Anionen-Transport in sekretorisch epithelialen Zellen. Eine Fehlfunktion dieses Proteins in zystischer Fibrose beeinflusst Chloride, Bicarbonate, Natrium und Wassertransport in epithelisches Gewebe, was dort zu Ausscheidungen und Wunden führt.
Material und Methoden
- Biologisches Modell: CHO Zellen, die die humane Form des CFTR Proteins (CHOcftr) ausdrücken
- DHM® Lösung: nicht-invasives, optisches Messen der CFTR Protein Aktivität
- Elektrophysiologisches Messen: ganzes Zell-Patch-Clamp-System integriert ins DHM (Illustration 1)
- Jodid-Ausfluss Monitoring: die CFTR Protein Aktivität wurde bestimmt mit dem Messen der Jodid (125I) Ausfluss-Rate vom CHOcftr
Resultate
Das DHM® kann nicht-invasiv die Aktivität des CFTR Proteins messen und dabei seine pharmakologischen Parameter bestimmen, in einem ähnlichen Umfang wie die Patch-Clamp-Technik oder Jodid-Ausfluss-Assays. Damit bietet das DHM® eine neue Möglichkeit zum Studium funktionaler Zusammenhänge auf diesem Forschungsgebiet.
Figur 4 (adaptiert von Jourdain et al., JCS, 2014)
Publikationen